
摘要 近年来,益生菌复配技术因多靶点协同效应而成为食品、医药领域的研究热点。本文系统梳理益生菌菌株复配的研究现状、生态学理论及关键影响因素,并形成共识。复配益生菌通过交叉喂养、功能互补及生态位竞争等生态学机制,显著提升肠道菌群调节、免疫增强及代谢改善等健康效应。临床证据显示,复配菌株在消化系统疾病、代谢性疾病、自身免疫性疾病及感染性疾病的干预中虽展现较好的效果,但其优势并非普遍适用,复配策略仍需结合疾病机制、菌株特性及协同效应进行综合评估。共识强调,未来研究应聚焦菌株互作机制解析,AI驱动的复配方案预测及标准化生产工艺开发,同时关注复配菌株的适用边界与风险规避,推动益生菌复配从经验驱动向数据驱动的范式转变,为精准化健康干预提供科学依据。
关键词 益生菌复配; 菌株互作; 生态学理论; 肠道菌群; 多靶点
益生菌作为一类基于调节宿主肠道微生态平衡发挥健康作用的活的微生物,近年来从基础研究到产业化开发呈现出协同快速发展的态势,在食品、医药、农业及环保等行业已得到广泛的应用。在常规益生菌产品研发过程中,首先基于单菌株的筛选、生理特性及功能研究,然后开展复配产品开发,此过程需要兼顾理论依据和应用场景[1-2]。人工智能(AI)技术的出现颠覆了这一研究范式,即:基于深度学习算法构建“iProbiotics”平台[3],依托乳酸菌基因组数据,采用机器学习、深度学习等先进算法,将传统方法3~6个月才能完成1株益生菌菌株的评价,大幅提升至2 h/株,效率提高1000倍以上,准确度高达97.77%。同时,AI在益生菌功能基因挖掘方面具有突出优势。例如,在预测乳酸菌的免疫调节功能时,AI模型可以同时考虑菌株的基因组特征、代谢产物谱以及与宿主微生物群的互作关系,从而全面评估其潜在健康作用效果[4]。AI技术还能够识别传统方法难以发现的微小基因变异与表型关联,为理解益生菌功能机制提供了新视角[5]。这种数据驱动的研究范式,不仅加速了已知功能菌株的筛选过程,还有助于发现具有新型益生特性的菌株资源。
食品用益生菌复配是将不同菌株进行科学组合,通过菌株间的互补以及协同效应,实现更有效地调节人体的健康状态[6]。多元化的益生菌复配产品用于健康管理,已成为益生菌相关产品开发的重要方向。本文基于我国益生菌产品以多菌株复配为主的情况,系统分析益生菌复配的研究现状、理论依据、菌株复配的主要影响因素等,并提炼出益生菌菌株复配的基本共识,旨在为科学研究与产品开发提供理论支持。
益生菌的研究最初主要集中在单菌株筛选以及对调节人体肠道菌群作用的评价,而后续越来越多的研究证明,益生菌不仅有利于肠道健康,还存在“肠-脑轴”效应,进而拓展到“肠-X轴”,进一步证实了益生菌与人体健康的密切关系。越来越多的研究者开始探索多菌株复配对多靶点健康作用的功效[7]。在市场调研中可见,益生菌产品中以动物双歧杆菌(Bifidobacterium animalis)、长双歧杆菌长亚种(Bifidobacterium longum subsp. longum)、动物双歧杆菌乳亚种(Bifidobacterium animalis subsp. lactis)等双歧杆菌与鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus)、嗜酸乳杆菌(Lactobacillus acidophilus)、干酪乳酪杆菌(Lacticaseibacillus casei)等乳(酪)杆菌复配的居多(图1)。

1.1 复配益生菌的临床功效研究
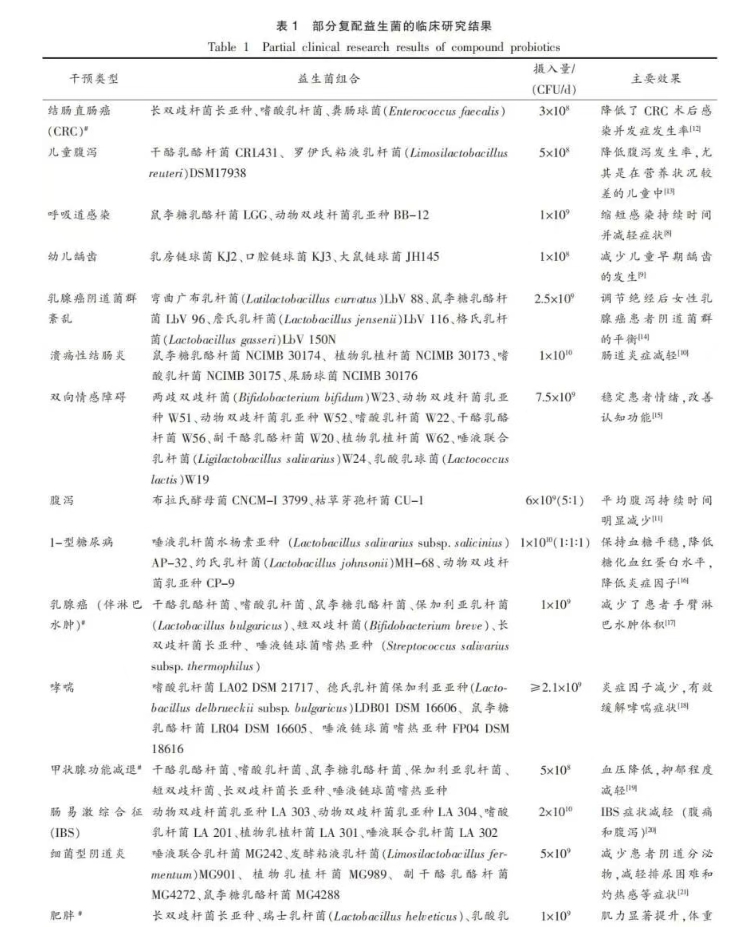
针对多种疾病的临床干预中发现,复配益生菌通过调节肠道菌群平衡,增强免疫功能,改善代谢状态以及修复肠道屏障等多种机制,在消化系统疾病、代谢性疾病、自身免疫性疾病及感染性疾病的干预中展现较好的效果。益生菌的摄入量范围基本在108~1010 CFU/d。临床研究表明,含有鼠李糖乳酪杆菌LGG和动物双歧杆菌乳亚种BB-12的益生菌制剂能够有效缩短成人患上呼吸道感染的持续时间,并减轻其不适症状[8];含有3种益生菌【乳房链球菌(Streptococcus uberis)KJ2、口腔链球菌(Streptococcus oralis)KJ3、大鼠链球菌(Streptococcus rattus)JH145】的咀嚼片,可以减少儿童早期龋齿的发展[9];摄入由鼠李糖乳酪杆菌NCIMB 30174、植物乳植杆菌(Lactiplantibacillus plantarum)NCIMB 30173、嗜酸乳杆菌NCIMB 30175和屎肠球菌(Enterococcus faecium)NCIMB 30176复配的益生菌制剂缓解了溃疡性结肠炎患者的肠道炎症[10];1种由布拉氏酵母菌(Saccharomyces boulardii)CNCM-I 3799和枯草芽孢杆菌(Bacillus subtilis)CU-1组成的复合益生菌剂可有效缩短腹泻持续时间[11](详见表1)。

1.2 益生菌复配菌株的功效研究
复配益生菌的健康作用效果需要基于菌株特性、菌群间的协同效应及对健康作用调节机制等多方面进行综合评估。目前,多项临床研究表明,复配菌株因菌群间的协同或加和效应,常表现出较好的效果。
1) 复配菌株的协同作用优势
在益生菌的临床研究中,基于菌群间的协同或加和效应,多项研究比较了单菌株与多菌株的健康作用效果,结果显示复配菌株的临床效果较为显著。例如,在幽门螺旋杆菌清除试验中,鼠李糖乳酪杆菌GG(LGG)与动物双歧杆菌乳亚种BB-12联用的清除率显著高于单一菌株,其机制可能与双歧杆菌黏附力增强有关[24]。1项针对IBS的随机双盲临床研究表明:由LGG、Lc705、普氏乳杆菌及双歧杆菌组成的4菌株复配在症状缓解效果较好[25-27]。另1项关于IBS的研究发现,单独使用LGG菌株效果有限,显示LGG菌株需与其它菌株协同作用以发挥疗效[28]。在儿童轮状病毒腹泻的干预中,含嗜酸乳杆菌、鼠李糖乳酪杆菌、长双歧杆菌长亚种及布拉氏酵母菌的复配制剂对呕吐等症状的缓解效果显著优于单菌株[29]。临床荟萃分析显示,75%的研究表明复配方案在干预IBS和腹泻及免疫调节等方面的效果更具有优势[30]。在早产儿坏死性小肠结肠炎(NEC)干预中,多菌株联用显著降低发病率和死亡率,其机制可能涉及免疫调节与肠道屏障增强及免疫调节[31-32]。
2) 复配菌株的非绝对性
然而,复配菌株的疗效并非在所有情况下均优于单菌株。1项系统评价显示,单一鼠李糖乳酪杆菌与4菌株复配制剂在治疗特应性皮炎时效果相当[24]。另1项针对婴儿特应性皮炎的双盲试验发现,鼠李糖乳酪杆菌与其它菌株联用反而抑制了其单菌株的功效[33]。同样,在1项益生菌对克罗恩病干预效果的研究中,单菌株与多菌株复配方案的临床效果差异不显著[34]。
复配益生菌通过多菌株间的协同作用,在多种疾病的干预中展现出显著的临床潜力,尤其在消化系统疾病、代谢性疾病及免疫相关疾病等方面。然而,益生菌复配的功效优势并非通则,需结合个体特异性、菌株特性及协同机制等进行个性化设计。未来研究应进一步探索菌株间的相互作用机制,优化复配方案,以实现益生菌的精准化干预。
1.3 AI技术在益生菌复配研究中的应用
基于传统技术方法开展益生菌复配设计,难以有效预测复杂菌群互作关系,而AI技术可通过建立菌株互作预测模型,为益生菌复配设计提供配方依据。Yang等[35]基于保加利亚乳杆菌和唾液链球菌嗜热亚种的多源数据集,开发了一对一和二对二筛选模型,准确度分别达到85%和90%。这些模型能够预测不同菌株组合的发酵特性,包括产酸、产黏和产香等关键指标。生物验证实验显示,AI筛选出的协同组合确实表现出更优的发酵性能,代谢组学分析进一步证实这些组合能够产生更多有益代谢产物,如己酸、异己酸等。
随着个性化益生菌产品需求的日益增长,基于耦合多层感知器的代谢物反应预测模型(McMLP)等深度学习方法能够基于个体基线微生物群和代谢组数据,准确预测特定益生菌干预后的代谢反应[36]。例如,通过分析个体肠道菌群结构与短链脂肪酸等特定代谢物的关联模式,AI模型可以推荐最可能改善该个体肠道健康的菌株组合[37]。这种个性化方法大幅提高了益生菌干预的针对性和有效性,为代谢性疾病患者、免疫力低下者等特需人群提供了更精准的健康管理方案。
此外,AI技术能够解析微生物群落的时空动态变化模式。例如,深度学习模型可以预测微生物在肠道、发酵食品等不同环境中的演替规律,有助于优化益生菌的递送方式和剂量[38]。同时,AI技术还能结合宏基因组学和宏转录组学数据,预测微生物功能基因的表达动态,从而评估益生菌在不同生理状态下的干预效果[39]。这种基于AI的动态分析能力,使得益生菌的应用从静态经验性补充转向动态精准调控,进一步提高了其临床和产业应用价值。
益生菌菌株复配可以是功能的叠加,也可以是基于生态学理论的多维度协同设计,通过模拟肠道菌群的天然互作网络,实现功能增效与生态稳定性。生态学理论中菌种之间的相互作用既可以是消极的,也可以是积极的。如1株菌株可能通过营养物竞争或代谢产物中的化学成分抑制另1株菌株的生长,或1株菌株通过增加营养物质可用性和创造新的生态位促进另1株菌株的生长。2个菌株之间的双向相互作用是由菌株之间的2个单向相互作用决定的,常见的互作机制主要有交叉喂养、功能互补、生态位竞争等。
2.1 交叉喂养机制
交叉喂养是指1种微生物依赖另1种微生物的代谢活动,并从中获得其生长所需关键因子的合作关系,即具备复杂化合物降解能力的初级降解菌在分解底物时释放代谢副产物,这些副产物随后被缺乏独立分解能力的次级降解菌所利用,从而形成营养依赖关系,构建共生网络,这一机制基于微生物的“代谢分工”。
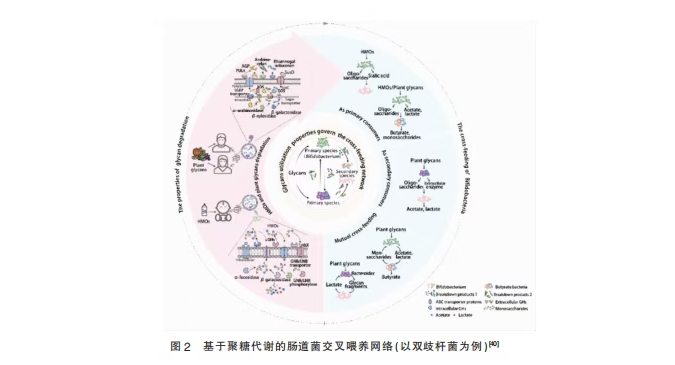
交叉喂养存在于代谢互补的物种之间,双歧杆菌编码的碳水化合物降解酶(CAZymes)数量仅次于拟杆菌,拟杆菌的多糖利用位点(PULs)系统与双歧杆菌的ABC转运系统具有互补特性。例如,双歧杆菌虽不能直接利用阿拉伯木聚糖,但当双歧杆菌与拥有胞外木聚糖降解能力的卵形拟杆菌共同培养时,双歧杆菌可以有效摄取卵形拟杆菌的降解产物——低聚木糖,然后再由双歧杆菌编码的专用ABC转运蛋白将低聚木糖转运至细胞内完成进一步降解(见图2)[40-41]。
具有相似营养代谢的双歧杆菌物种可以通过交叉喂养而不是竞争关系来扩大它们的营养生态位。例如,两歧双歧杆菌PRL2010缺乏利用植物聚糖(如淀粉和木聚糖)的降解系统,当与青春双歧杆菌22L、短双歧杆菌12L和嗜热双歧杆菌JCM1207共培养时,它可以利用其它双歧杆菌释放的简单碳水化合物,并促进其糖利用基因表达[42]。这些物种之间的互作有助于宿主扩大对特定碳水化合物的利用潜力。
2.2 益生菌菌株功能互补机制
益生菌菌株复配的功能互补机制是通过两种或多种具有不同益生功能菌株的结合,以增强或扩展其对宿主健康的益处。不同特异性的微生物-微生物相互作用,可能会通过聚糖降解过程中产生的代谢物影响宿主健康。
补充含有双歧杆菌的多菌株合生元,以构建肠道不同成员之间的相互作用网络,可以帮助肠道微生物群在生命早期成熟和稳定,并增加有益代谢物(如丁酸盐)的分泌,最终预防与肠道微生物群失衡相关的慢性疾病[43]。这种菌株的协同组合协同调节肠道微生物群和健康稳态,并且比单一菌株受内源性微生物的影响更小[44]。例如,Button及其团队开发了一种HMO+长双歧杆菌婴儿亚种的合生元,通过促进乙酸盐和丁酸盐的产生来改善肠道菌群的失衡并影响肠杆菌科的生长。该团队的后续研究发现,这种依赖HMO的双歧杆菌策略可以增加乳酸消费者(韦荣氏菌属)的丰度,并通过减少促炎代谢物对甲酚硫酸盐来缓解抗生素诱导的肠道微生物群失调[45-46]。还有研究通过使用阿拉伯木聚糖治疗肥胖症,发现长双歧杆菌长亚种通过与其它肠菌【拟杆菌属(Bacteroides)、考拉杆菌属(Phascolarctobacterium)和罕见小球菌属(Subdoligranulum)】的共生网络关系,利用阿拉伯木聚糖降解释放的低聚糖,促进肠道中乙酸盐的产生并减轻肥胖[47]。
2.3 生态位竞争
生态位竞争是指不同物种或同一物种的不同个体为了争夺有限的资源和空间而发生的相互作用。这种竞争是生态系统中普遍存在的现象,它影响着物种的分布、丰度和进化。多糖利用偏好被认为是定义肠道微生物组成员生态位的关键营养因素[48]。调节肠道微生物群落的过程通常被认为是生态位驱动的,可用的营养物质谱决定了微生物能否成功建立健康的肠道生态位,且其动态平衡由资源利用策略与代谢协同性共同塑造。
除了交叉喂养互作关系,肠道微生物也有可能相互对抗,争夺周围环境中可用的营养物质。某些拟杆菌属也存在营养竞争,部分的降解多糖仅供自己使用,而不是交叉喂养给其它微生物。微生物通过“自私-无私”双模式调控资源分配:以拟杆菌属为例,多形拟杆菌(B. thetaiotaomicron)在降解酵母α-甘露聚糖时采用自私模式,通过表面锚定的内切α-甘露糖苷酶限制胞外水解,仅允许特定分子质量(800~1200 u)的寡糖进入周质空间完成代谢,有效阻止竞争者获取中间产物;而卵形拟杆菌(B. ovatus)在分解半纤维素时则切换至无私模式,主动释放低聚木糖作为公共产物,为共生菌群创造生态位扩展条件。这种代谢策略的可塑性揭示了微生物通过权衡(Trade-off)优化适应性的本质,即自私模式强化个体竞争优势,而无私模式通过促进生态位扩张以及群落稳定性,从而获得长期进化收益[49]。
系统发育距离通过代谢网络异质性深刻影响生态位演变轨迹。当远缘物种(系统发育距离>0.35)建立交叉喂养关系时,其代谢模块的互补性可突破哈钦森(Hutchinson)基础生态位边界,使共培养体系的碳源利用种类扩展40%~60%。例如拟杆菌门与厚壁菌门的组合能协同降解复杂多糖,将纤维素的代谢效率提升至单菌体系的2.8倍,这种协同源于跨门类菌株间糖苷水解酶与转运蛋白的功能耦合。相反,近缘物种(距离<0.15)因核心代谢通路高度重叠,生态位竞争强度增加3~5倍,最终导致21%~34%的碳源利用范围收缩。这种规律在拟杆菌属内尤为显著:多形拟杆菌与卵形拟杆菌共培养时,通过代谢物交换使甘露糖利用率提升至单培养的1.8倍,然而,两者在葡萄糖利用上呈现强烈竞争,生长速率较单独培养下降42%[50]。由此可见,两个密切相关的细菌占据的代谢生态位空间比两个更远的个体更相似。这种关系可以解释为什么两个近亲比两个远缘的不同物种之间更有可能存在生态位的竞争。
基于生态位竞争理论,复配菌株的选择可以做出以下考量:1)优先选择系统发育距离较远、代谢功能互补的菌株组合,以扩大碳源利用范围并提升协同效率;2)避免近缘菌株的过度组合,以减少核心代谢通路重叠导致的资源竞争;3)针对目标底物的降解需求,筛选具有酶系互补性的跨门类菌群(如拟杆菌门与厚壁菌门),通过功能耦合实现代谢效率的最大化。这种基于生态位竞争的理性设计,可为构建稳定、高效的复配益生菌制剂提供理论指导。
合理设计的复配益生菌虽可通过多靶点机制(如调节肠道微生态,增强黏膜屏障,调控宿主免疫等)提升宿主健康效应,但人群的个体差异性、菌株复配的比例和量效关系及菌株加工稳定性等是影响其功效的主要因素。
3.1 宿主肠道菌群的差异性
益生菌的单菌株健康作用机制、宿主互作关系及量效关系研究范式虽相对成熟,但宿主肠道菌群的差异性对复配菌株健康作用效果的解释性增加了难度,主要是复配菌株的作用靶点多,多菌株量效关系不单一,且宿主肠道原生菌群的生态位竞争与代谢互作缺乏量化模型,复配菌株的生长适应性易受到干扰[51]等。功能性消化不良患者的肠道菌群特征表现为乳杆菌和双歧杆菌丰度降低,而肠杆菌科等机会致病菌比例升高,因此,复配方案可以选择具有竞争性抑制条件致病菌能力的菌株,复合产短链脂肪酸以及促进消化酶分泌和肠屏障修复的菌株[52]。帕金森病(PD)患者的肠道菌群失衡则呈现产丁酸菌减少及促炎菌增殖的特征,其复配方案需纳入具有神经保护功能的菌株,通过调节氧化应激和肠道免疫通路发挥协同疗效[53-56]。综上,益生菌复配需要考虑宿主个体基线菌群结构、代谢表型及免疫状态等诸多因素。
为应对宿主的差异性问题,可以利用宏基因组学、蛋白组学等多组学技术筛选宿主的特异性生物标志物,指导复配益生菌的精准优化。根据宿主的肠型、疾病和代谢特征等进行复合益生菌模块化设计,精准组合不同益生菌的功能特性,以实现针对不同人群的有效益生菌复配。
3.2 菌株复配的比例及量效关系
菌株复配比例的系统优化仍面临多维动态互作的复杂性,菌株间营养竞争、代谢物抑制等互作模式具有显著的异质性、功能互补性与拮抗作用等[57]。因此,益生菌作用效果同时受到非线性量效关系和个体异质性的双重挑战。临床研究表明,复配菌株的剂量-效应曲线呈钟型响应特征,其峰值剂量受宿主肠道菌群基线组成、免疫状态及代谢表型等多因素调控[58]。此外,多维度技术融合将推动复配策略的范式革新。例如,基于多组学驱动的菌株互作网络解析,可构建菌株功能互补性量化评价体系。利用宏基因组学识别菌株间代谢通路耦合节点,结合代谢组学定量代谢物交叉喂养阈值,可建立“代谢互作热力图”预测菌株比例[59]。深度学习算法可通过整合菌株生理参数(如耐酸耐胆盐阈值、代时等)与宿主表型数据,构建剂量-效应关系的动态仿真模型,实现“菌株比例-宿主响应”的个性化匹配[60]。
3.3 原料菌株的加工特性及复配菌株的功能稳定性
生产工艺直接影响单菌株的存活性能,进而影响复配菌株的活性和功能。真空冻干技术作为主流解决方案,显著提升了益生菌在加工与胃肠道环境中的稳定性。复配菌株需要在产品贮藏过程中维持其功能的稳定,各单菌株稳定性是决定复配菌株功能稳定性的基础。功能稳定性则需监测货架期内菌株衰减率、功能代谢物(如短链脂肪酸)含量及菌群比例变化情况等。
益生菌菌株复配技术的开发与应用始终面临科学潜力与产业化挑战的复杂平衡,动态评估模型的开发将成为关键。例如结合代谢通量分析与机器学习,实时解析多菌株复配体系的代谢网络变化,预测菌株互作中的竞争或协同效应[61]。
3.4 复配菌株的定量与活性检测技术
益生菌产品的健康效应需具有菌株特异性与剂量依赖性的双重加持[62]。因此,建立“菌株水平精准鉴别”与“活菌定量”技术,是复配益生菌产品检测与监测的刚性需求[63]。当前复配菌株检测体系面临遗传同源菌株不易识别、活/死菌区分技术瓶颈及多菌种同步定量缺失等核心技术挑战。传统平板计数法虽操作简便,但受限于同源菌株形态相似性导致的特异性不足[64]。利用流式细胞术结合指征菌株活性的荧光基团虽可以实现活菌定量,但特异性染料的筛选和复杂菌群中特异菌株独立计数都具有较大的难度[65-66]。当前分子检测技术通过核酸特异性识别机制突破传统局限,形成以荧光定量PCR(qPCR)与数字PCR(dPCR)为核心的技术路线[67]。qPCR基于实时荧光检测建立定量模型,虽具有检测周期短,特异性强和高灵敏度等技术优势,但受标准曲线依赖性和死菌DNA干扰限制;dPCR通过样本微分割与泊松分布算法实现绝对定量,虽规避标准曲线需求且抗干扰性强,但设备成本较高[68]。针对死菌干扰难题,叠氮溴化丙啶(PMA)预处理技术通过光敏交联选择性清除死菌DNA,可显著提升活菌检测精度[69-70]。
针对传统靶标基因(如16S rRNA、pheS)因保守性不足而导致的同源菌区分难题,正通过比较基因组学筛选新型分子标记(如菌株特异性SNP/质粒区域)以求突破。基于乳酸菌比较基因组学分析挖掘乳酸菌特性新分子靶标基因,具有更高的特异性和可靠性,可实现食品等样品中常见乳酸菌精准、快速鉴定和批量化定量检测。此外,多菌株同步检测受限于引物交叉反应与设备成本的影响,需开发CRISPR-Cas靶向富集或微流控芯片技术提升通量。
综上所述,本文通过对复配益生菌的科研与产业现状、理论基础及影响因素等进行系统分析,经专家组多次讨论,形成以下观点:
1) 多菌株复配是益生菌产品创新与开发的重要方向。现有研究表明复配益生菌的多靶点作用对宿主健康维护具有良好的效果。益生菌菌株复配可以是基于多种作用机制加持的特定健康作用的叠加,也可以是多菌株复配实现多个健康作用的有效干预。然而,由于复配菌株产品的健康效应受到健康状况、宿主肠道微生态差异及单菌株特性的复杂调控,因此未来益生菌复配仍需要充分的科学循证,以验证复配菌株产品针对不同的人群的健康效应。
2) 生态学理论是益生菌菌株互作及复配的参考依据。益生菌菌株复配的生态学理论主要有菌株的交叉喂养、功能互补、生态位竞争等。基于目前研究,尚未发现益生菌复配存在安全性问题。以益生菌健康作用效果为导向,基于生态学理论的多维度协同设计,通过模拟肠道菌群的天然互作网络,可实现功能增效与生态稳定性。未来,可研究系统解析菌株互作机制,建立复配比例与宿主响应的量化模型等,为益生菌菌株复配提供可靠并可量化的科学证据。
3) 宿主肠道菌群差异性、原料菌株加工特性及稳定性是益生菌复配的主要影响因素。针对宿主的个体差异性问题,结合精准医学和分子生物学技术,通过宏基因组学、蛋白组学等多组学技术筛选宿主的特异性生物标志物,指导复配益生菌的精准优化。此外,还要进一步强化生产工艺技术创新,以提升复配菌株的存活率、货架期稳定性及其功能。未来,遵循“精准设计-工艺适配-稳定性监控”的原则,推动益生菌标准化生产工艺的技术创新,可为优化复配益生菌的应用提供坚实的技术支撑。
4) 菌株水平精准鉴定与活性评价是复配益生菌产品质控的关键技术。复配益生菌产品健康功效的发挥需要满足各菌株足够的数量要求。然而,当前复配菌株检测体系面临遗传同源菌株不易识别、活/死菌区分技术瓶颈及多菌种同步定量缺失等问题,且现有体系侧重活菌数量而忽视功能活性评估,亟待整合代谢组学标记构建“数量-功能”双维模型。未来,技术创新可关注AI算法优化引物设计、耐热DNA聚合酶开发等,进一步推动检测体系向多菌种、高通量、功能化方向演进,支撑益生菌产业标准化与个性化的升级。
5) AI技术将助力益生菌复配从“经验驱动”向“数据驱动”的转变。当前,益生菌菌株科学复配的常规研发逻辑是基于清晰的单菌株功效证据。未来,随着人工智能、大数据技术及组学技术的有机融合,有望推动益生菌复配从“经验驱动”转向“数据驱动”。基于组学技术、机器学习或深度学习技术,通过分析人群肠道菌群信息、健康数据、益生菌菌株基因组及代谢组信息等,可预测最佳益生菌菌株复配方案。AI学习临床研究数据,可模拟复配益生菌产品作用效果,然而,数据伦理问题、益生菌实际临床功效评价的一致性等问题尚需进一步研究。
中国食品科学技术学会益生菌分会. 益生菌菌株复配的专家共识[J]. 中国食品学报, 2025, 25(07): 455-467.
DOI:10.16429/j.1009-7848.2025.07.039.